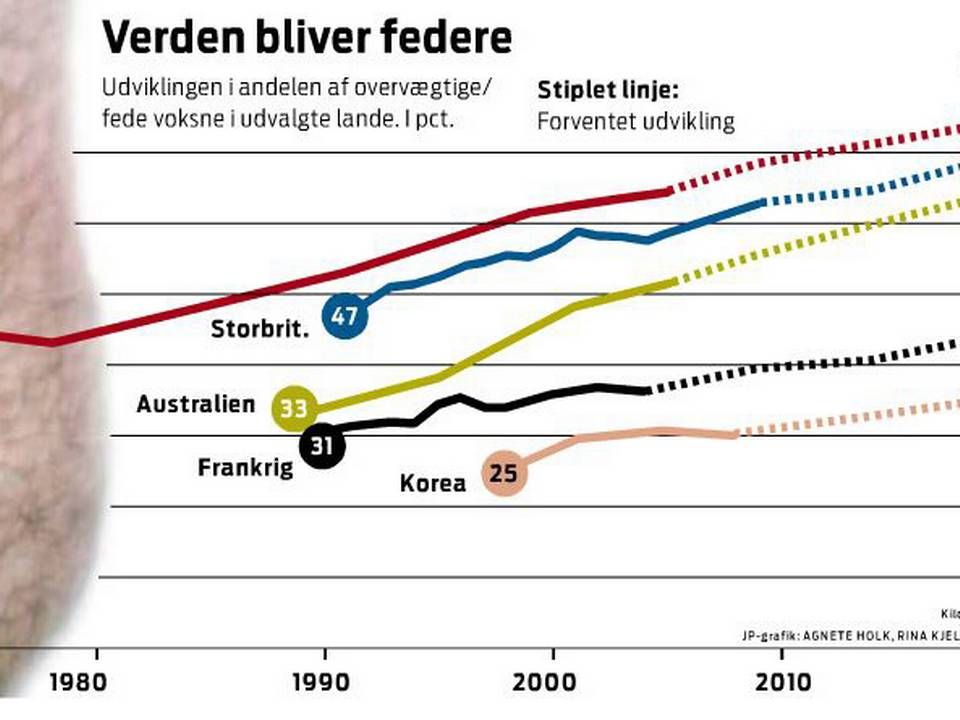
Novos fedmedrøm markant tættere på at blive opfyldt

Med stemmerne 14 for og 1 imod blev det til en markant sejr for danske Novo Nordisk, da et rådgivende panel under FDA sent torsdag aften i Maryland anbefalede de amerikanske myndigheder at godkende Saxenda - det danske selskabs lægemiddel til fedmebehandling.
Dermed er Novo Nordisk torsdag aften efter et otte timer langt møde kommet endnu tættere på at få godkendt milliardhåbet. FDA ventes at tage stilling til en evt. godkendelse omkring 20. oktober.
"Det var et relativt fredeligt ekspertpanelmøde, hvor man i store dele af tiden sad med fornemmelsen af, at ekspertpanelet var positivt stemt over for Saxenda. Panelet anerkendte den effekt, midlet havde, ikke mindst på de afledte effekter af fedme, eksempelvis type 2-diabetes, prædiabetes, forhøjet blodtryk og fedtforstyrrelser," siger Sydbank-analytiker Søren Løntoft Hansen til MedWatch.
Rimelig sikker
Meldingen fra ekspertpanelet er ikke bindende for FDA, der dog ofte følger eksperternes anvisninger. Det gælder ikke mindst, når anbefalingerne er enstemmige. En undersøgelse i 2010 viste, at FDA i de fire foregående år havde fulgt anbefalingerne i tre ud af fire sager. Kun i forbindelse med tre lægemidler godkendte FDA efterfølgende et lægemiddel, som komitéen ikke havde anbefalet.
"Den bør være rimelig sikker, selv om der jo altid er en usikkerhed," lyder det fra analytikeren.
FDA havde på forhånd opfordret ekspertpanelet til at fokusere på særligt fem områder:
• Hjerte-kar-bivirkninger
• Cancer
• Psykisk påvirkning
• Galdeblæresygdom
• Betændelse i bugspytkirtlen
Ser ud til at slippe for ekstra studier
Men ifølge Sydbank-analytiker gled mødet forholdvist godt for det danske selskab, når det kom til diskussioner om bivirkninger.
"Novo Nordisk slap rigtig godt fra spørgsmålene til risici vedrørende betændelse i bugspytkirtlen, forskellige kræftformer, galdeblæresygdomme osv. Man skal selvfølgelig fortsat observere forekomsten af disse, men det kan gøres via de igangværende LEADER-studier med Victoza, som afsluttes i 2016," siger han og tilføjer:
"De fokuserede lidt på de forhøjede hjerteslag, men det var faktisk relativt lidt. Man sagde, at det ikke var bekymrende, og hvis ellers LEADER-studierne viser, at der ikke bør være bekymring for hjertekarsygdomme, så ser det ikke umiddelbart ud som om, at Novo Nordisk behøver at gennemføre dedikerede hjertekar-studier med Saxenda, da hovedparten af komitéen sagde, at man kunne ”nøjes” med LEADER-studierne i den lave dosis."
Novo Nordisk missede i februar 2013 netop godkendelsen fra de amerikanske myndigheder i forhold til diabetesmidlet Tresiba, da det pålagt selskabet at udføre dedikerede hjertekarstudier, før en evt. godkendelse kunne falde.
Den ene nej-stemme skyldtes bekymring for, om midlet kan øge risikoen for forskellige kræftformer.
Milliardforventninger
Der var i alt 15 stemmeberettigede medlemmer af komitéen, som ledes af fungerende formand Kenneth Burman, overlæge og chef på den endokrinologiske afdeling ved Washington Hospital Center. Udover Kenneth Burman er der en forbrugerrepræsentant, en patientrepræsentant og en lang række af professorer i bl.a. medicin og statistik.
Novo Nordisks hold på mødet var udgjort af Robert Clarke, ansvarlig for Regulatory Affairs hos Novo Nordisk i USA, Anne Phillips, senior vice-præsident for Clinical & Regulatory Affairs hos Novo Nordisk i USA, Lotte Bjerre Knudsen, ‘opfinderen’ af liraglutid-molekylet, og Alan Moses, Global Chief Medical Officer.
Salgsforventningerne blandt analytikerne er ifølge Ritzau Finans spredte. I gennemsnit venter 12 analytikere, der har indberettet tal til SME Direkt, at salget kan nå 11,1 mia. kr. om året, når det topper. Den mest positive analytiker ser et salgspotentiale på 18,3 mia. kr. i 2025, mens den mest pessimistiske kun venter et salg på 3,8 mia. kr. dog i 2020.
Natten mellem onsdag og torsdag blev Orexigen og Takedas fedmemiddel godkendt. Contrave er blot den tredje godkendelse af et fedmemiddel i USA i løbet af mere end ti år, efter at midlerne Qsymia fra Vivus og Belviq fra Arena Pharmaceuticals begge blev godkendt i 2012. De to midler er begge blevet set som blockbusterkandidater på et tidspunkt, men har haft yderst svært ved at leve op til forhåbningerne.
Vanskeligt marked
En væsentlig opgave for Novos amerikanske salgsstyrke bliver således, at opdyrke et marked for medicinsk fedmebehandling, der igennem de senere år er faldet til blot ca. 0,5 mia. kr. For lægernes modtagelse af de i 2012 to godkendte midler har langt fra været varm, ligesom der tidligere er blevet trukket midler tilbage som følge af alvorlige bivirkninger.
Langt hovedparten af fedmepatienterne i USA behandles med et generisk produkt ved navn Phentermine.
Fedmemidlerne dækkes stadig ikke af de nationale forsikringsprogrammer som Medicare og Medicaid, og det er fortsat kun halvdelen af folk med private sundhedsforsikringer, der får dækket brugen af fedmemedicin. Men får medicinalselskaberne hul igennem til ikke mindst betalerne af lægemidlerne, det vil sige sygekasserne, kan markedspotentialet være stort.
Samtidig er Novo Nordisks argument, at man vil gå fokuseret efter en mindre del af markedet og slå på, at Saxenda kan være medvirkende til at forebygge diabetes, hvilket skal være med til at retfærdiggøre den høje pris, som forventes at ligge på omkring 32 dollar om dagen mod de i dag godkendte midler, der ligger på 5-6 dollar om dagen.
”Der har vi meget længe meldt ud til markedet, at vores hensigt er at gå målrettet efter det segment af den medicinsk fede befolkning, som har store problemer ved det – det kan være prædiabetes, søvnapnø og stor overdødelighed pga. hjertekar-sygdomme,” sagde forskningsdirektør Mads Krogsgaard Thomsen til MedWatch i forbindelse med indsendelsen af fedmeansøgningen i december og tilføjede:
”Hvis vi troede, at vi skulle bruge det her til alle mennesker, så ville det være håbløst, fordi prisen ville blive vurderet som værende alt for høj. Men hvis man målretter det til den føromtalte patientgruppe, som er dem, der hver især årligt koster samfundet tusinder af dollars i meromkostninger pga. deres fedmekomplikationer. Hvis vi helt kan forebygge, at de får de komplikationer, samtidig med at de får et længere og et bedre liv, så er det da langt at foretrække. Det vil vi gå til markedet med.”
MedWatch følger op med kommentarer fra Novo Nordisks forskningsdirektør Mads Krogsgaard Thomsen i løbet af fredag formiddag.
Udviklingen i New York varsler kursrekord for Novo
Dette står i vejen for Novos fedmegodkendelse
Novos fedme-sats går imod alle odds
Novo: Det føles ret stort faktisk
Novo går efter mindre del af fedmemarkedet
Relaterede artikler
Novos fedme-sats går imod alle odds
For abonnenter
Novo: Det føles ret stort faktisk
For abonnenter