Roches brystkræftmedicin tæt på Europa
De europæiske medicinmyndigheders evalueringskomité, CHMP, har givet en positiv anbefaling af lægemiddelkandidaten Kadcyla, som er udviklet af den schweiziske koncern Roche. Det oplyser selskabet i en pressemeddelelse.
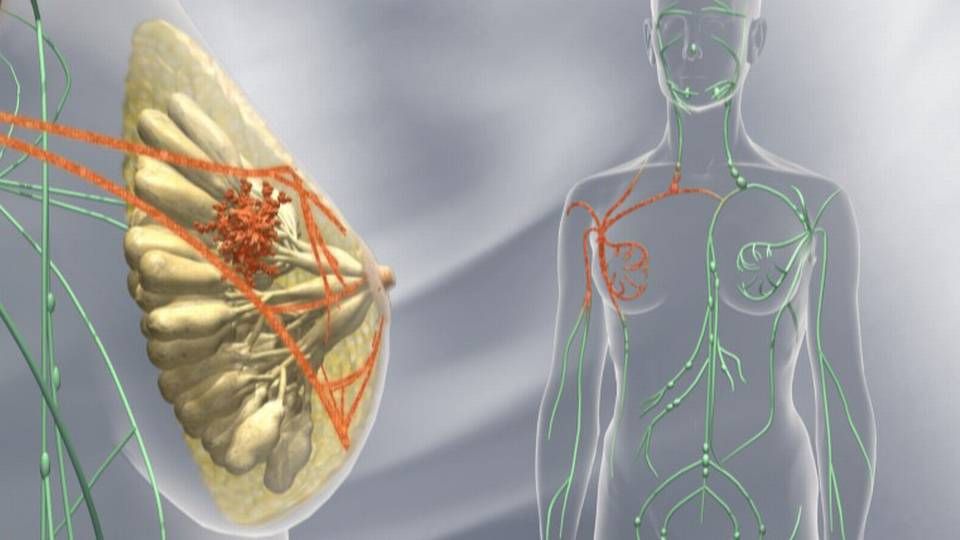
Lægemidlet er en antistofkonjugat til behandling af såkaldt HER2-positiv, metastatisk brystkræft, og ifølge Roche er Kadcyla den første af sin slags mod denne indikation.
Det er på nuværende tidspunkt ikke muligt at kurere patienter, som lider af metastatisk brystkræft, så behandlingen er rettet mod at forlænge levetiden for de kvinder, som rammes af kræfttypen.
Og her har et fase 3-forsøg vist, at Kadcyla kunne forlænge den gennemsnitlige levetid med 2 år og 6 måneder for patienter, som tidligere havde modtaget behandling for sygdommen. Samtidig registrerede man færre negative bivirkninger.
Direkte levering
Roches lægemiddel kombinerer HER2-hæmmeren trastuzumab - som også er den aktive ingrediens i et andet af virksomhedens lægemidler mod brystkræft, Herceptin - med kemoterapien DM1. Og med denne kombination er man i stand til at levere kemoterapien direkte til det kræftramte område uden at ramme det omkringliggende, raske væv, oplyser selskabet.
”Kadcylas højst effektive, målrettede virkningsmekanisme tilbyder patienter en mulighed for at forlænge deres liv med færre af de bivirkninger, som sædvanligvis ses i forbindelse med kemoterapi. Vi håber, at denne nye medicin snart er tilgængelig for patienter med metastatisk brystkræft i Europa,” udtaler Hal Barron, som er Chief Medical Officer i Roche.
EU-Kommissionen forventes at tage stilling til, om Kadcyla skal godkendes i Europa inden årets udgang. Lægemidlet har allerede opnået markedsgodkendelse i USA.































