Sandoz indgår partnerskab om efterligning af blockbustermiddel fra Roche
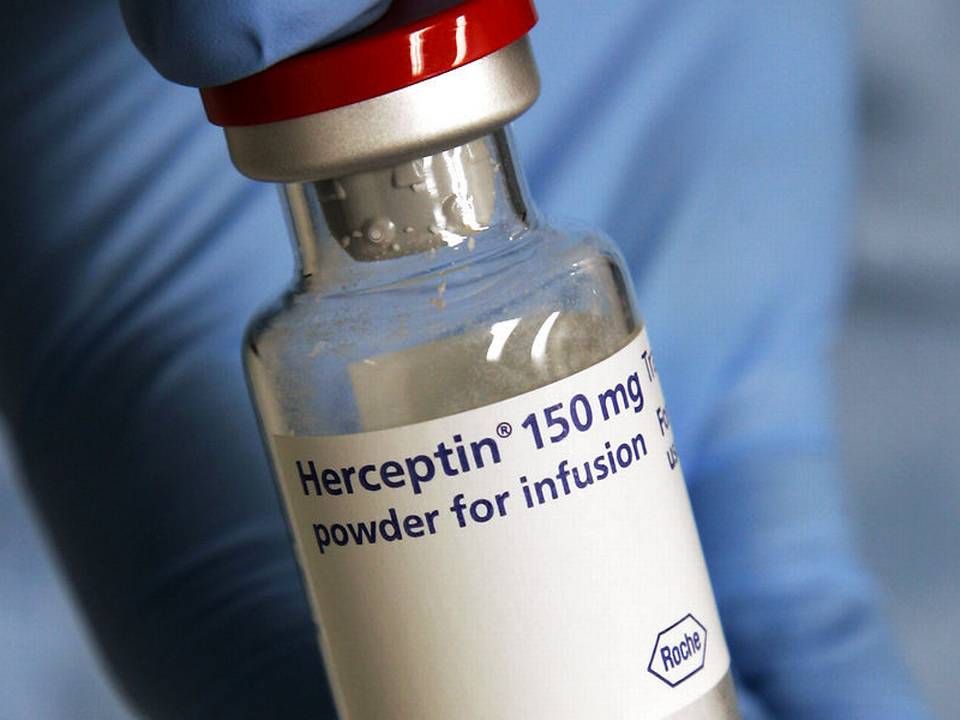
En ny efterligning af Roches blockbuster og brystkræftmiddel Herceptin er trådt et stort skridt nærmere markedet, efter at Novartis-selskabet Sandoz har indgået et partnerskab med medicinalselskabet Eirneix fra Taiwan.
Sammen skal de to firmaer videreudvikle og markedsføre en biosimilær version af Roches monoklonale antistof Herceptin (trastuzumab), der for nuværende er i fase 3, og som skal bruges som behandling af HER2-positive brystkræftpatienter og patienter med mavekræft.
Det oplyser Sandoz i en meddelelse.
Ifølge aftalen får Eirgenix ansvaret for udvikling og fremstilling af det biosimilære kræftmiddel, mens Sandoz får retten til at kommercialisere produktet på alle markeder bortset fra Kina og Taiwan.
For ydelsen modtager Eirgenix en ikke-nærmere defineret engangsbetaling, milepælsbetalinger og en "andel af overskuddet fra salget", som Novartis udtrykker det.
Aftalen med Eirgenix er den tredje af slagsen for Sandoz inden for en periode på blot 18 måneder og bringer Sandoz’ kræftportefølje af biosimilære lægemidler op på fire.
Boom i biosimilære lægemidler
Herceptin blev oprindeligt udviklet af Genentech og markedsføres af moderselskabet Roche, som i 2017, inden patentudløb, på globalt plan omsatte for et beløb svarende til ca. 44 mia. kr., hvilket gjorde Herceptin til verdens femte bedst sælgende lægemiddel i 2017.
Alene i Danmark omsatte Herceptin for ca. 200 mio. kr. årligt, inden indtoget af biosimilære for alvor tog fart.
I marts blev Pfizers Trazimera således den fjerde biosimilære version af Herceptin godkendt af de amerikanske sundhedsmyndigheder, som for alvor har fået gang i blåstemplingen af biosimilære midler under ledelse af den nyligt afgående FDA-chef Scott Gottlieb.
I alt har FDA sagt god for 18 biosimilære midler, hvoraf den første blev godkendt i marts 2015.
Til sammenligning har det europæiske lægemiddelagentur EMA godkendt 51 biosimilære midler, hvoraf fem er versioner af Herceptin. Pfizers Trazimera er også godkendt i Europa. I Danmark sagde Medicinrådet god for de første versioner af biosimilær Herceptin i juni sidste år.
Biosimilærer er biologiske lægemidler fremstillet af levende organismer. De er ikke direkte kopiprodukter, men de genskaber den effekt, kvalitet og sikkerhed, som man får fra et givent biologisk lægemiddel, og sælges ofte langt billigere end originalproduktet.
Omtrent 300.000 kvinder bliver hvert år diagnosticeret med HER2-positiv brystkræft.
Sandoz ledes midlertidigt af Francesco Balestrieri, der for nyligt afløste den hidtidige topchef i selskabet, Richard Francis. Sidstnævnte sagde sit job op, da han ikke kunne forlige sig med Sandoz’ strategi, der kort fortalt går ud på, at Sandoz skal satse mere på biosimilære midler og "kompleks" generisk medicin, såsom injicerbare midler, øjenmedicin og luftvejsmidler.
Strategien indebærer også, at Sandoz vil producere efterligninger af insulin fra Novo Nordisk, Eli Lilly og Sanofi.
Sandoz omsætter for cirka 60 mia. kr. årligt.
Novartis-selskabet Sandoz får ny direktør
Pfizer får godkendt efterligning af Roche-middel i USA
Kræftblockbuster fra Roche får biosimilær konkurrence i Danmark
Relaterede artikler
Novartis-selskabet Sandoz får ny direktør
For abonnenter
Pfizer får godkendt efterligning af Roche-middel i USA
For abonnenter