Diabetesselskab fyrer og stopper studier efter FDA-afvisning
Det amerikanske biotekselskab Intarcia Therapeutics lukker nu ned for flere kliniske studier i den sene udviklingsfase og gør klar til at fyre 60 medarbejdere.
Det skriver Boston Business Journal.
Det sker, efter at de amerikanske lægemiddelmyndigheder, FDA, tilbage i september sidste år afviste at godkende selskabet hovedaktiv ITCA 650 til behandling af type 2-diabetes.
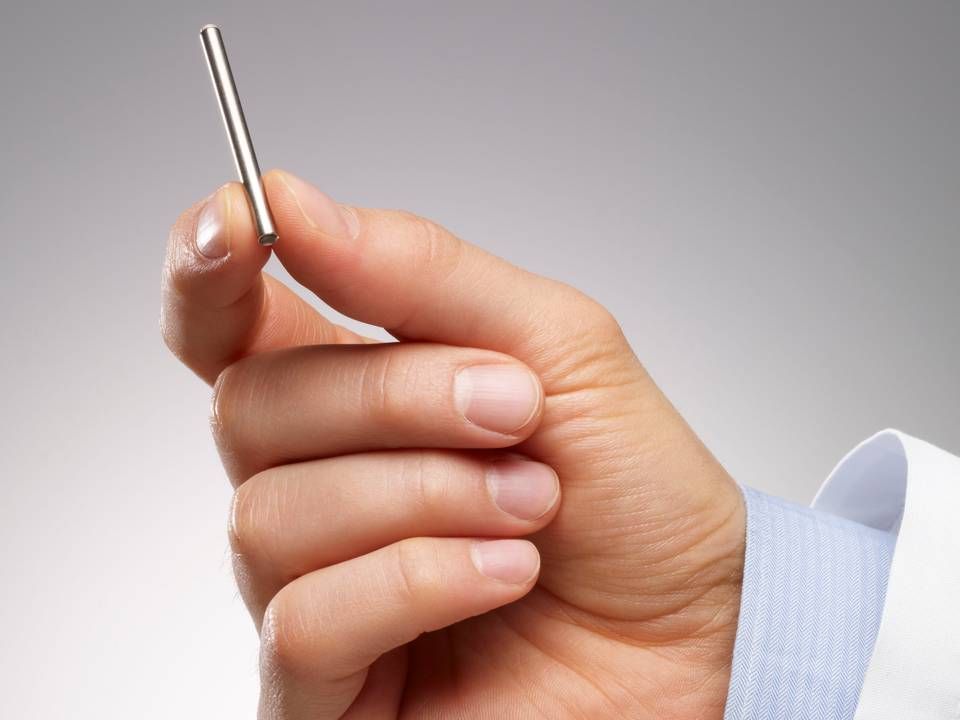
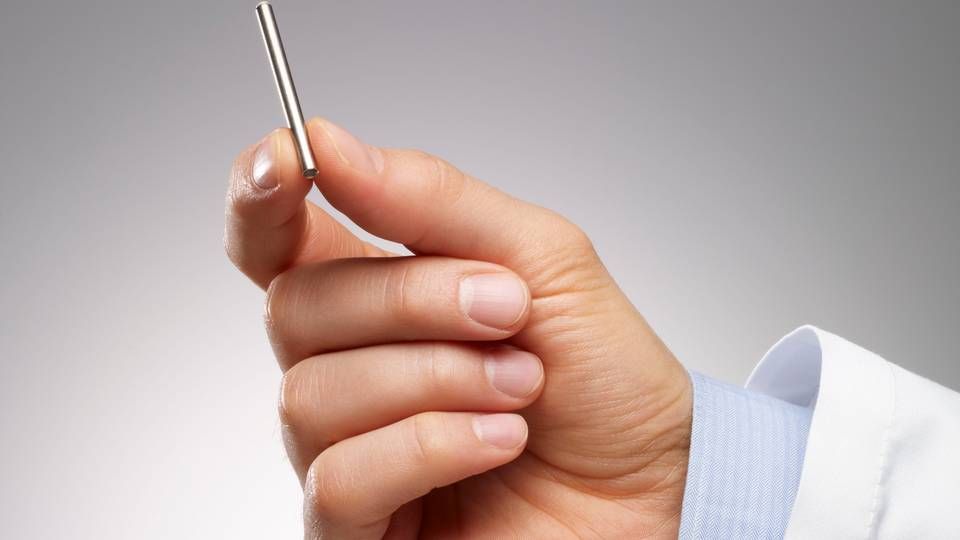
Intarcia har udviklet et særligt system til automatisk levering af lægemiddelstoffer til behandling af kroniske sygdomme. ITCA 650 er en lille pumpe på størrelse med en tændstik, der placeres under patientens hud. Implantatet leverer herfra en stabil dosis af GLP-1-midlet exenatid, der markedsføres af AstraZeneca som produkterne Byetta og Bydureon.
Udstyret har tidligere vist lovende resultater i studier, hvor det blev sammenlignet med andre diabeteslægemidler. Men produktionsproblemer betød, at FDA ikke ville godkende det i denne omgang. Myndighederne har samtidig sat to fase 3-studier med ITCA 650 i bero ved at placere dem under såkaldt clinical hold. Men ifølge selskabet er ingen af de to studier en del af ansøgningspakken for produktet.
En omstrukturering i selskabet betyder samtidig, at man vil fyre 60 af sine cirka 300 ansatte. Men adm. direktør Kurt Graves siger til Boston Business Journal, at man også er i gang med at ansætte nye medarbejder, og han forventer ikke, at den samlede medarbejderstyrke ændrer sig væsentligt.
FDA dumper Intarcias diabetespumpe
Diabetesfirma når ny milepæl med særlig pumpe
Diabetesselskab køber biotekfirma af tidligere GSK’ere
Relaterede artikler
Diabetesfirma når ny milepæl med særlig pumpe
For abonnenter
Diabetesselskab køber biotekfirma af tidligere GSK’ere
For abonnenter